RADIOAKTIF, ISOTOP DAN
PENANGGALAN
Peluruhan
radiokatif pada isotop tertentu dapat terjadi secara alami dan digunakan untuk
mengukur umur meteor dan jejak evolusi. Sebelum ditemukan radioaktif pada tahun
1896, untuk mengetahui peristiwa urutan
geologi sangat sulit dan tidak aman (bab 4.2). Sedimentasi dan catatan foso;
merupakan fokus dari sejarah geologi tetapi sekarang periode geologi berbasis fosil terkait dengan peristiwa
umur isotop. Prinsip dari penentuan umur peluruhan radiaktif membutuhkan pengukuran tepat dari kelimpahan
isotop. Metode isotop menjadi sangat sensitif terhadap variasi yang sangat
kecil dalam rasio isotop elemen cahaya pada peristiwa radioaktivitas.
Pada
buku ini dibedakan tiga kategori isotop radioaktif yang menarik (Tabel H.1,
H.2, H.3 pada Lampiran H). Tabel H.1 daftar isotop yang tidak diproduksi di
bumi atau atmosfer oleh proses berlanjut, dan harus diperhitungkan dalam
persediaan elemen dalam akresi asli bumi. Pada kasus yang penting (235U)
mempunyai waktu paruh kurang dari 109 tahun dan isotop tersebut
sangat sedikit atau isotop yang ketersediaannya jarang misalnya isotop 146Sm,
dan mempunyai waktu paruh 108 tahun. Banyak jenis yang mempunyai
waktu hidup lebih pendek dan dapat diproduksi secara bersama-sama, tetapi
sekarang jenis-jenis tersebut telah menghilang. Hal ini menjadi petunjuk bahwa
peristiwa sistesis nuklir terakhir menghasilkan bahan dari tata surya yang
terjadi beberapa milyar tahun yang lalu. Kegunaan dari isotop dan peluruhan
radioaltif untuk pembentukan unsur-unsur dan Bumi dipelopori oleh Ernest
Rutherford, yang pekerjaan didokumentasikan dalam tinjauan menerangi oleh
Fowler ( 1961). Rutherford mencatat bahwa unsur yang mempunyai nomor atom z, dimana termasuk uranium (z = 92), isotop dengan massa atom lebih
dari rata-rata normal dengan massa atom yang aneh. Dia menyimpulkan bahwa 235U
tidak pernah lebih dari 238U dan menggunakan fakta bahwa waktu
paruh lebih pendek dari 235U
dikaitkan dengan usia isotop tersebut. Dengan nilai modern dari waktu paruh dan
perbandingan lebih, pendapat tersebut berlaku batas usia 5,9 miliar tahun. Ini jauh kurang
dari usia alam semesta, seperti disimpulkan dari konstanta Hubble dan radiasi
sinar kosmik latar belakang (13,7 miliar
tahun). Tetapi kurangnya unsur dengan waktu paruh jauh lebih sedikit
dibandingkan dengan 235U menunjukkan bahwa bumi lebih muda dari elemen-elemen
ini. Seperti sekarang kami menyadari, interval antara sintesis elemen berat dan
pembentukan tata surya jauh lebih pendek dari kehidupan berikutnya dari Bumi (Bagian
4.4). Alasan ini sangat menarik pada beberapa isotop yang mempunyai waktu yang
lebih pendek pada Tabel H.3 karena meskipun tidak terukur jumlah sisanya,
merupakan produk dari peluruhan yang dapat diidentifikasi menjadi meteor yatim
(bagian 4.4) dan menyediakan lebih perkiraan intervl kecepatan.
Ada
juga yang berumur pendek yang terjadi secara alami pada unsur radioaktif (Tabel
H.2), tetapi unsur radioaktif baik yang dihasilkan oleh penembakan sinar kosmik
dari atmosfer atas, dan diendapkan dengan hujan, atau terus-menerus diproduksi
di bumi atau lautan sebagai hasil menengah dalam peluruhan rantai uranium dan
thorium. Unsur radioaktif tersebut digunakan untuk pelacak proses geologi
dengan skala waktu yang paling pendek yang dipelajari dari isotop yang ada pada
Tabel H.1. salah satu yang paling menari dari sinar kosmik dihasilkan isotop 10Be,
dimana terakumulasi di sedimen laut, terlihat sampai mantel pada daerah
subduksi dan muncul dengan lava andesit (bagian 2.9). Ini menunjukkan bahwa sedimen
laut basah subduksi, menjadi fluks untuk magma andesit (Bagian 2.5), dan yang seluruh
proses hanya memakan waktu paruh beberapa 10Be, kurang dari 10 juta
taun. Contoh yang paling berguna dari hasil isotop menengah adalah 230Th,
produk langsung dari 234U dalam rantai peluruhan 238U,
akhirnya meluruh ke 206Pb. 230Th, dengan waktu paruh 75
000 tahun, diproduksi di kulit makhluk laut yang menggabungkan beberapa
uranium, dan menyediakan alat untuk waktu karbonat sedimentasi.
Variasi kecil dalam jumlah relatif isotop
dari unsur cahaya biasa muncul dari
proses fisik dan kimia (Bagian 3.9), tanpa radioaktivitas. Perbedaan massa
antara isotop menyebabkan massal gesekan, sehingga, Misalnya, air yang menguap
dari lautan sedikit habis dalam deuterium relatif ke laut air, karena molekul
cahaya menguap lebih mudah daripada yang lebih berat. Partisi isotop juga
terjadi antara berinteraksi mineral dan mencerminkan kondisi (suhu dan tekanan)
dimana air datang ke equilibrium. Lebih variasi
isotop dramatis ditemukan di baik butir di chondrite karbon (Bagian 2.4), namun
diberikan ke pelestarian tidak dicampur bahan dari sumber-nukleosida sintetis
yang berbeda. Mereka menyajikan petunjuk untuk pra-sejarah thematerial dari
Tata Surya (Bagian 4.5).
Alasan lain yang menarik dari
radioaktivitas adalah merupakan sumber panas. Radiaktivitas adalah sumber
energi yang berkelanjutan di Bumi (bab 21) dan distribusi merupakan pokok dari
pembahasan pada sejarah thermal (bab 23). Dalam hal ini ada empat pokok isotop
yaitu 238U, 235U, 235Th dan 40K. Empat
isotop tersebut berada di kerak dan didistribusikan pada mantel. Adanya
radioaktivitas di inti telah diperdebatkan tetapi, jika ada beberapa panas
radiogenik, itu memudahkan masalah menemukan sebuah memadai sumber energi untuk
dinamo geomagnetik (Bab 24). Kasus untuk beberapa K dalam inti adalah dibahas
dalam Bagian 2.8 dan implikasi untuk sejarah termal dalam Bab 23.
Peluruhan Radioaktivitas
Laju
peluruhan radioaktivitas dari suatu isotop dinyatakan dengan konstanta
peluruhan, λ, dimana probabilitas per satuan waktu yang konstituen partikel
dalam inti atom akan melarikan diri melalui penghalang potensial mengikat ke nukleus.
Dengan demikian laju peluruhan N inti adalah sebanding dengan N:
Mengintegrasi
dari nomor awal N0 pada
waktu t = 0, sehingga dapat
menentukan persamaan peluruhan:
Hubungan
antara λ dan waktu paruh, T1/2,
dari sebuah isotop dapat ditentukan dengan mensubtitusikan N=N0/2 pada saat t=T1/2,
Energi nuklir mengikat begitu besar dan inti
atom yang sangat kecil sehingga radioaktif peluruhan hampir tidak terpengaruh
oleh kondisi fisik di bumi, seperti suhu dan tekanan. Peluruhan akibat
kehilangan partikel α, β-, dan β+ (elektron
atau positron) menyebabkan terjadi dengan penetrasi hambatan potensial yang
mengikat partikel-partikel ini ke inti. Probablitas semata-mata milik inti.
Probabilitas peluruhan oleh fisi, dimana inti membelah menjadi dua fragmen
ditambah neutron, juga dinyatakan oleh konstanta peluruhan. Sebuah proses yang
berbeda adalah penangkapan orbital elektron. Hal ini dikenal dengan penangkapan
K karena hampir selalu merupakan elektron dari terdalam (K) shell elektron yang
ditangkap. Pada kasus ini laju tergantung pada rapat massa lokal dari orbital
elektron pada inti.
Waktu peluruhan: Umur 14C
Waktu
peluruhan dapat dihitung dengan menggunakan persamaan 3.2. mengukur bagian yang
meluruh (N) dari isotop dibandingkan
dengan bagian awal sebelum meluruh (N0)
dan t dihitung dari ratio. Yang
paling penting adalah 14C, dimana yang dihasilkan dari (n,p) sinar
kosmik neutron pada atmosfer 14N. Isotop 14C tergabung
dalam vegetasi dengan fotosintesis, sehingga material awal biologi dapat diukur
dengan menggunakan metode 14C. 14C terdapat pada contoh
fosil kayu atau tulang mahkluk hidup yang telah mati, waktu diaktifkan, dan
umur dapat diketahui dengan menentukan jumlah dari 14C yang tersisa.
Metode ini sangat efektif untuk material yang mempunyai waktu paruh 5730 tahun
dan namun tidak tepat digunakan untuk material atau fosil yang lebih muda atau
tua.
Perbandingan atom 14C di
atmosfer (normal sekitar 1 atom di 1012) sudah berubah karena
akivitas manusia sekitar 100 tahun yang lalu. Pembakaran bahan fossil dalam
skala besar telah menginjeksi 14C pada atmosfer yang tidak terlihat.
Pada tahun 1950an, pada atmosfer dideteksi bahwa terdapat dua kali lipat 14C
karena senjata nuklir. Untungnya, keadaan tersebut tidak mempengaruhi
unsur-unsur yang memiliki umur lebih tua, tetapi ada kenaikan unsur 14C
pada atmosfer melalui variasi medan geomagnetik, dimana sebagian melindungi
bumi dari sinar kosmik dengan membelokan partikel primer (kebanyakan proton).
Penanggalan Akumulasi: Umur K-Ar dan U-He
Alternatif
pengetahuan langsung dari konsentrasi awal, N0,
dari parent radioaktive mengukur
konsentrasi, D* dari produk daugther
radioactive karena
Tanda
* digunakan pada D* untuk menunjukan jumah atau konsentrasi dari daugther radioactive yang dihasilkan
pada waktu t. Hal ini karena isotop yang sama dapat dihasilkan secara tiba-tiba
dari peluruhan dan non radiogenik atau komponen awal harus diikutkan dengan
membagi pers (3.4) dengan pers (3.2 untuk menghilangkan N0.
Untuk
skema peluruhan tanpa daugther
radioactive awal atau komplikasi lain, Persamaan. (3.5) dapat digunakan langsung
dalam penentuan usia. Hal ini hampir benar umur K-Ar, berdasarkan pada
peluruhan minor isotop Potassium, 40K ke 40Ar. Komplikasi
pada kasus ini tidak merupakan hal yang serius, hanya sekitar 10,5% dari 40K
meluruh menghasilkan 40Ar, sisanya meluruh β- menjadi 40Ca.
Perbandingan konstanta peluruhan unruk hasil 40Ar, λAr,
terhadap total yaitu
Dalam keadaan normal terdapat sangat sedkit
unsur argon dalam batuan beku, karena proses volatisasi dan inert kimia. Hal
ini hampir sepenuhnya hilang oleh pelepasan gas dari lava pendinginan. Kita
batuan beku ekstrusif memamadat, dengan tidak ada 40Ar, jam diset
menjadi nol. Sehingga untuk persamaan jam penanggalan menjadi modifikasi yang sederhana pada
persamaan
Persamaan diatas dapat digunakan untuk menentukan umur batuan dan mineral dengan menghitung
perbandingan unsur 40Ar/40K. Metode yang paling banyak
digunakan pada pengukuran argon dan potassium. Ini berarti hati-hati membagi
sampel menjadi dua bagian yang mengandung konsentrasi yang sama K dan Ar, dan
kemudian K diukur dalam satu setengah dan Ar yang lain. Pengukuran argon adalah
dibuat dengan spektrometer massa setelah leleh sampel dalam ruang hampa,
pencampuran argon yang dirilis dengan kuantitas yang diketahui secara isotop
dipisahkan 38Ar (spike) dan menghilangkan gas yang tidak diinginkan. Serta
memungkinkan untuk fakta bahwa spektrometer massa mengukur rasio sangat baik,
tapi tidak mutlak jumlah, dengan membandingkan tiga isotop argon prosedur ini
menyediakan metode rutin mengoreksi kontaminasi atmosfer. Di atmosfer argon
mempunyai isotop yaitu 40Ar, 38Ar, 36Ar = 100
; 0.063 ; 0.337.
Sebuah metode yang dapat digunakan
untuk menentukan perbandingan 40Ar/40K dalam sampel
adalah mengekspos dalam fluks neutron pada sebuah reaktor nuklir, mengkonversi
sebagian kecil dari yang 39K hadir untuk 39Ar. Dalam 39Ar
sehingga dihasilkan adalah ukuran langsung dari kandungan kalium, sehingga bahwa
rasio Ar / K dapat diukur dengan massa perbandingan spektrometer dari 40Ar
/ 39Ar. ini adalah lebih langsung daripada pengukuran terpisah pada
Ar dan K dengan metode yang berbeda pada sampel terpisah.
Reaksi Fisi
Penanggalan
akumulasi lain yang sangat sederhana dalam prinsip berdasarlam reaksi fisi
spontan pada 238U. Reaksi tersebut sangat jarang terjadi hanya 5.4 x
10-5 % dari pelruhan 238U, tetapi fragmen fisi tersebut
sangat memiliki energi yang sangat tinggi dan membawa 40-50 muatan elektron.,
sehingga dapat menghasilkan intensitas radiasi yang sangat berbahaya dan
merusak. Setiap reaksi fisi menghasilkan sepasang hasil. Ditandai dengan bagian
utama fragmen. Reaksi fisi spontan dari 235U dan 232Th
juga dapat terjadi namun hal itu jarang sekali terjadi dan dapat diabaikan.
Reaksi fisi adalah sebuah radiogenik daughter dimana
diyakini bahwa tidak ada kelimpahan awal. Sehingga akumulasi awal dapat
dihitung dengan menggunakan persamaan
Dalam kasus ini λp merupakan
konstanta peluruhan untuk reaksi fisi, dimana sangat kecil dibandingkan dengan
konstanta peluruhan total λ, dan T adalah jumlah reaksi yang dapat terjadi pada 238U
DAFTAR PUSTAKA
Stacey, F.D dan Davis, P.M.
2008. Physics of The Earth 5th .
New York. Cambridge University Press
Sismanto.
2012. Bahan Kuliah Fisika Batuan.
Yogyakarta. BOPTN P3-UGM


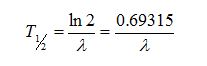




No comments:
Post a Comment